Le 4 juin 2006 :
Un article de : Lodewijk Gelauff, Rens Götz, Robert van Meer, John van Paridon, Kim Rooimans, Chantal Stoffelsma
Assistant au projet : Dr. M. Somers
Les Buts recherchés
Le but de ce projet est de
vérifier la validité du modèle informatique
représentant l'écoulement de l'acide chlorhydrique dans
de l'eau liquide. Plus spécifiquement, nous nous sommes
assurés que le modèle tienne compte de la dissociation de
l'acide chlorhydrique.
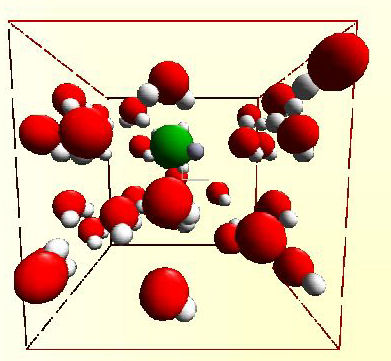
Shéma 1 : Image du modèle informatique
Dans cette simulation, nous utilisons une boite cubique de dimension 18,2 x 18,2 x 18,2 ao . La périodicité du système a été mise en place en accord avec la convention de l'image minimale du système. Le ratio entre l'eau et les molécules de chlorure d’hydrogène (HCl) est de 20 pour 1. Ceci signifie que la concentration dans le modèle est de 2.8 M. Les forces qui font agir les molécules d'eau entre elles ont été calculées selon le modèle de Ferguson.*
Dans ce modèle, la température est gardée constante en utilisant une méthode appelée weak coupling to an external bath. Dans cette méthode, les vecteurs de vitesse des particules de la simulation sont ajustés pour garder la température constante. En ce qui concerne notre simulation, les vecteurs sont ajustés sur une période de 8 picosecondes. Ceci signifie que les propriétés dynamiques des particules dans la simulation n'en ont pas été affectées.
Interactions
Il est possible de définir plusieurs types d'interaction entre les molécules, celles présentes dans notre modèle sont définies ci-dessous :
1) intéractions de Coulomb 2) interactions Lennard-Jones (circulaire) 3) interactions de Morse 4) intéractions harmoniques radiales 5) interactions harmoniques linéaires |
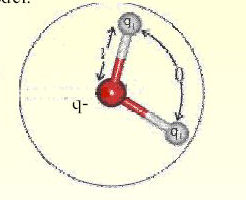 Figure 2 : interaction de Bend, Stretch, Coulomb et Lennard-Jones entre les molécules H2O |
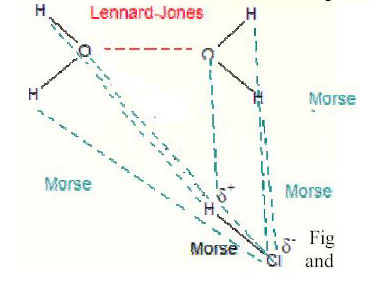
Figure 3 : Interactions de Morse, Lennard-Jones et Coulomb
Les interactions du modèle
Les interactions de Lennard-Jones expliquent la taille des molécules d'eau. Elles se repoussent quand on les rapproche sur des courtes distances, ce qui explique que la structure ne se heurte pas complètement en raison des interactions électrostatiques. Aux distances intermédiaires les molécules s'attirent
L'interaction de Morse est un potentiel qui décrit les mêmes sortes d'interactions que le potentiel de Lennard-Jonnes. Les interactions de Morse possèdent cependant un paramètre supplémentaire, c'est à dire que l'interaction de Morse peut être utilisée pour décrire la réalité plus aisément que l'interaction de Lennard-Jones.
Résultats
Après avoir fait tourné plusieurs calculs grâce au modèle, nous avons trouvé les résultats suivants :
1) Les molécules de HCl (chlorure d’hydrogène) n'ont pas été dissociées dans le modèle standard.
2) Avec une énergie de dissociation 3.5 fois plus élevée que l'original, le HCl a été dissocié.
3) La réduction de la charge négative vers une charge neutre de la molécule Cl (- 0.9 et 0) n'a pas mené à la dissociation. Cependant, la disposition des molécules d'eau autour de la molécule HCl devrait mieux coller à la réalité.
4) Utiliser un plus grand cube d'expérimentation ainsi qu'une concentration inférieure n'a pas d'effet sur la dissociation du HCl.
5) L'augmentation de la température (350 Kelvin et 400 Kelvin au lieu de 293 Kelvin **) n'a pas eu d'effet apparant sur la dissociation du HCl.
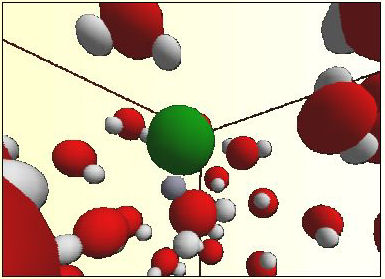
Figure 4: Dissociation de la molécule HCl en Cl- et
H3O+
Débat
L'énergie de dissociation utilisé dans le modèle original devra être réduite, parce que nous avons utilisé l'énergie constante de la HCl en tant que gaz au lieu de l'énergie propre de la HCl (aq)
Conclusion
La molécule HCl se dissocie lorsque l'énergie de dissociation de Morse est abaissée. Ceci avaitété prévu puisque la valeur utilisée dans l'hypothèse de départ était celle d'une HCl à l'état gazeux.
* D.M. Ferguson; J. Comp. Chem., Vol 16, No. 4, 501-511, Parameterization and Evaluation of a flexible watermodel
H.J.C Berendsen et al.; J. Chem. Phys. 81 (8), 15 Octobre 1984, Molecular dynamics with coupling to an externel bath
** 350K=77° , 400K=127° , 293K=20°


